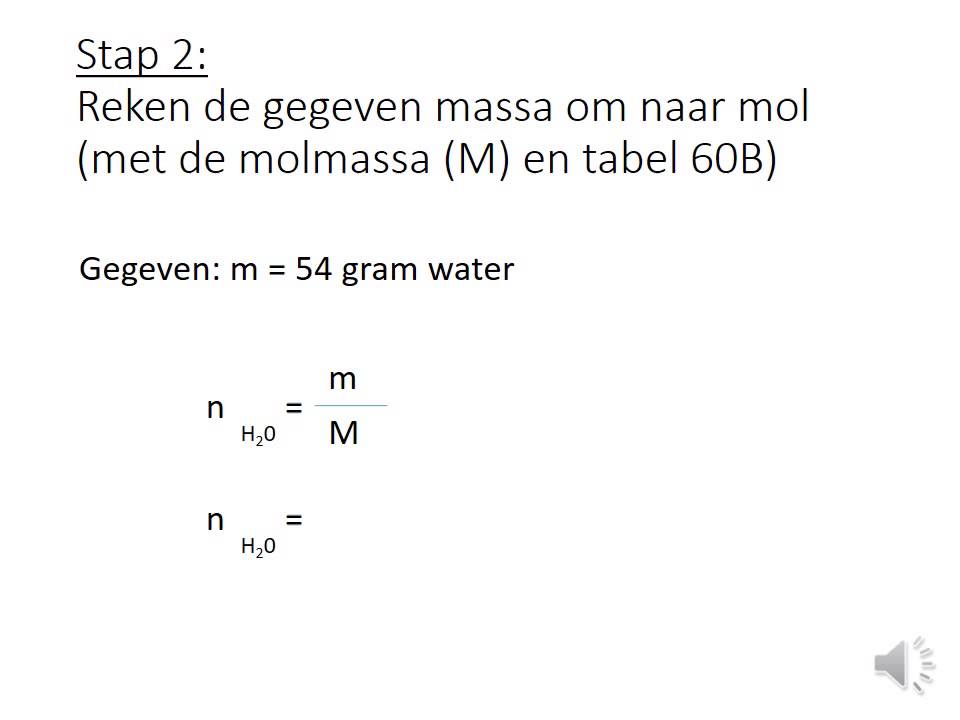
De mol (meervoud molen) is een van de zeven basiseenheden in het SI-stelsel, het Internationaal Stelsel van Eenheden.Het is de eenheid voor chemische hoeveelheid.Het gehanteerde symbool is eveneens mol.Eén mol is gelijk aan precies 6,02214076 × 10 23 deeltjes, zoals atomen, moleculen, ionen of bepaalde groeperingen van dergelijke deeltjes.. De mol wordt veel gebruikt in de scheikundige.. Als je het aantal gram van een stof weet en je de molaire massa hebt, kun je het aantal mol uitrekenen. Vanuit het aantal mol kun je ook de molariteit en de volume van een stof bepalen. Het aantal mol gedeeld door de volume geeft de molariteit (in M of mol/L ). De molariteit is eigenlijk hetzelfde als een concentratie, alleen gaat het om.
PPT Scheikunde PowerPoint Presentation, free download ID6136099

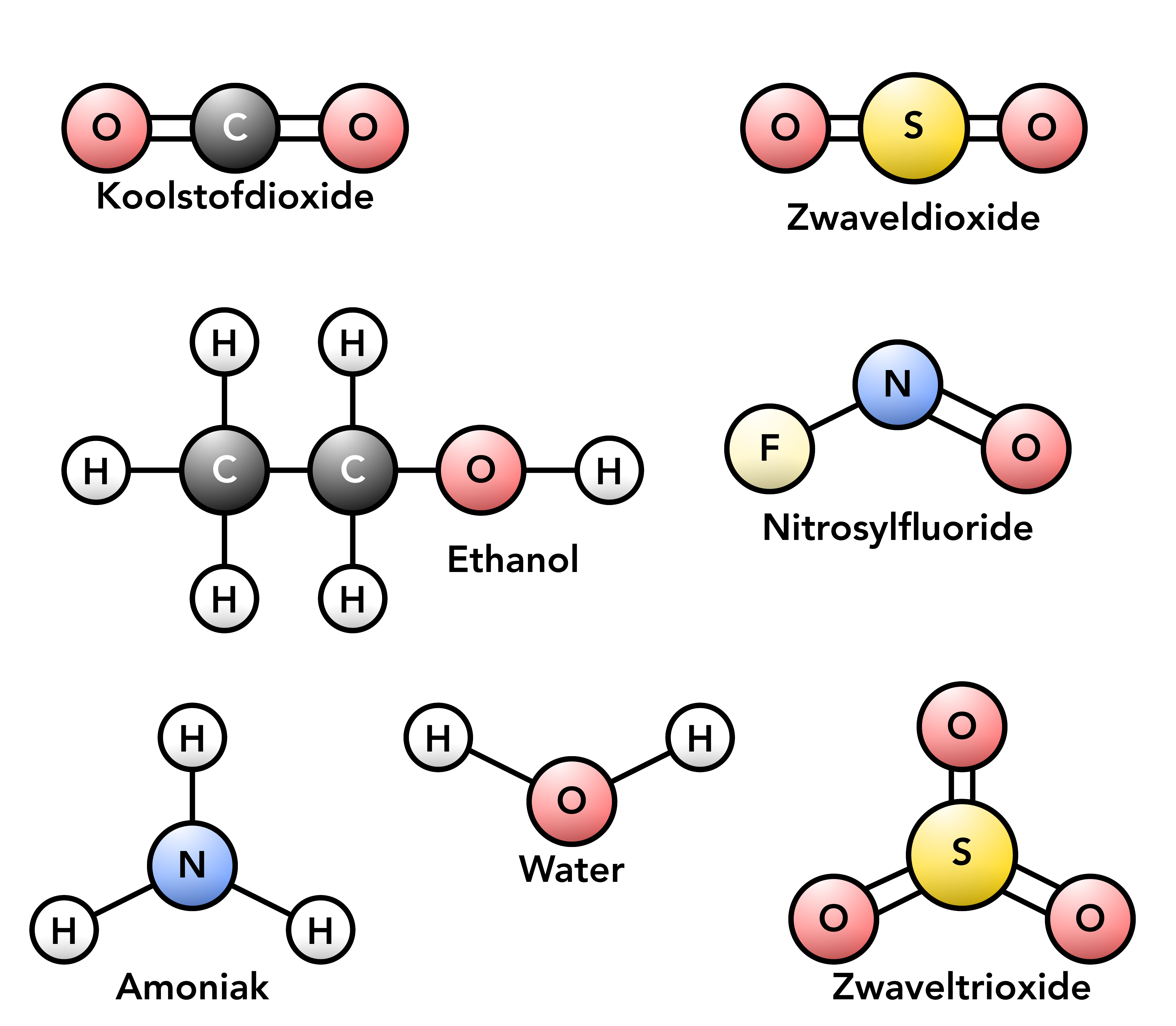
Verschil tussen mol en molecuul Algemene scheikunde 2024

Scheikunde blokjesschema BètaBijles Online

16 De mol deel 2 scheikunde YouTube
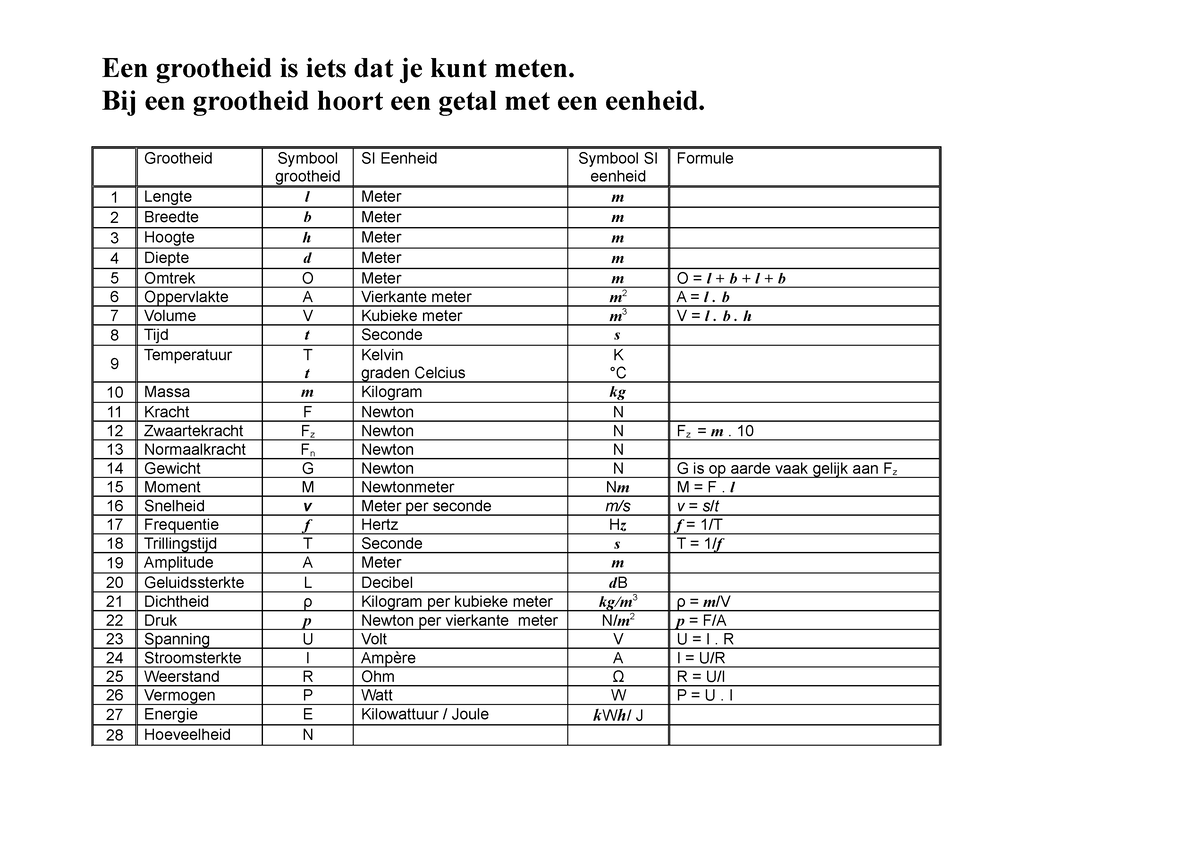
Tabel grootheid eenheden en formules tweede klas 4 Een grootheid is iets dat je kunt meten

Scheikunde Molecuulformules YouTube

N3J1P2L5 4 Wat is het molair volume YouTube

HAVO Scheikunde 20171 Kennis van stoffen en materialen een moeilijke opgave uitgelegd YouTube
:max_bytes(150000):strip_icc()/what-is-a-mole-and-why-are-moles-used-602108-FINAL-CS-01-5b7583f6c9e77c00251d4d68.png)
Wat is een mol en waarom wordt het gebruikt in de chemie?

Wie is de Mol bij scheikunde? Wolfert Dalton

Aristotle a book on Science

Waarom de mol? scheikunde YouTube

Examentip scheikunde Molrekenen YouTube
hoe bereken je volume met massa en dichtheid DrBeckmann

SEtraining Scheikunde Examentraining Haarlem
kwantitatieve analyse

Mol Rekenen met reactie YouTube

Examen scheikunde Molariteit van oplossingen (Zouten) YouTube

Daarom de mol! scheikunde YouTube
Aristotle a book on Science
In dit filmpje legt Noor je uit wat een mol en wat het getal van Avogadro is. Wil je meer uitleg over scheikunde? Kijk dan ook onze andere filmpjes op exactw.. Om te werken met mollen, moet je eerst weten wat de term Mol inhoudt: Iedere stof heeft z’n eigen eigenschappen. Lood is een vaste stof, en water is een vloeistof.. Nu is er in de scheikunde een term, die heet Mol. Iedere stof heeft een bepaalde molmassa, die te vinden zijn in scheikunde boeken, periodiek systeem en op internet.